子宫内膜癌是女性生殖系统常发生的恶性肿瘤之一,好发于围绝经期和绝经后女性。在我国,随着社会发展和经济条件的改善,子宫内膜癌的发病率亦逐年升高。白细胞介素17(IL-17或IL-17A)是由TH17细胞分泌的前炎症因子,具有促炎及抗炎双重作用。近年研究显示,IL-17作为重要的炎症因子在众多类型肿瘤中扮演重要角色,比如肠癌、皮肤癌、乳腺癌、前列腺癌、肺癌和胰腺癌等。子宫内膜癌的病因迄今尚不明确。本实验选择高分化的人子宫内膜样腺癌Ishikawa细胞,给予外源性IL-17A处理,通过细胞划痕实验检验IL-17A对Ishikawa细胞迁移的影响,并检测迁移相关蛋白MMP-9的表达,为探讨IL-17A在子宫内膜癌转移中的作用及其机制提供实验依据。
1 材料与方法
1.1 细胞株
Ishikawa细胞株,为高分化子宫内膜样腺癌,ER、PR均为阳性,PTEN活性缺失,本实验室保存。
1.2 主要试剂与仪器
RPMI-1640培养基、胎牛血清(美国,GIBCO公司),胰蛋白酶(美国,SIGMA公司),青链霉素双抗PS(美国,Hyclone公司)人重组IL-17A(美国,R&D公司),兔抗人MMP-7单克隆抗体、兔抗人MMP-9单克隆抗体(美国,Epitomics公司)。细胞培养箱(Thermo),Real-time PCR仪、Bio-rad MINI转移电泳仪、化学发光成像系统(美国,Bio-rad公司)。
1.3 实验方法
1.3.1 细胞培养
Ishikawa细胞细胞培养于60mm细胞培养皿中,含10%胎牛血清、1% PS的RPIM-1640培养基,放置于37°、5% CO2的培养箱中传代培养,每2~3天传代一次。用0.25%胰蛋白酶消化传代,细胞呈单层贴壁生长。
1.3.2 实验细胞分组与给药
将细胞分为对照组、IL-17A处理组。按1×105/孔将细胞接种于6孔板,培养24小时,待细胞达到90%以上融合,无血清培养20小时,然后用20ng/ml IL-17A处理细胞。
1.3.3 细胞划痕实验检测Ishikawa细胞迁移能力的变化
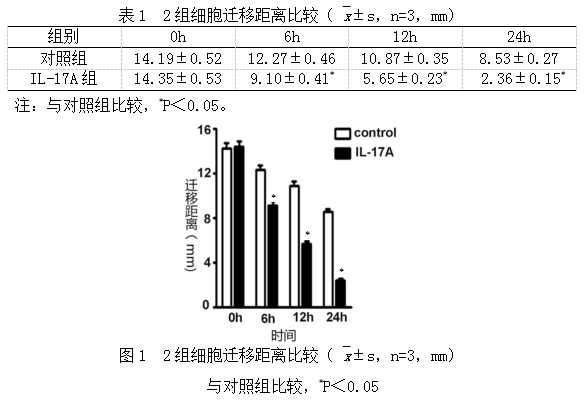
IL-17A处理细胞2h进行细胞划痕实验:用10μl枪头比着直尺,垂直于培养板划痕,用PBS洗涤细胞,以去除划下的细胞,洗涤3次之后加入无血清RPIM-1640培养基,置于37℃、5%CO2的细胞培养箱中培养,分别于0、6、12、24h,显微镜下观察拍照。使用Image J软件打开图片后,随机划取6~8条水平线,计算细胞间距离的均值。每个时间长度细胞整体迁移的距离=每个时间点的距离长度-0h距离,求出均数和标准差,时间为横轴,迁移距离为纵轴(mm)作图,并比较初始0h与实验结束时试验组与对照组的照片。
1.3.4 Western-blotting检测MMP-7、MMP-9蛋白表达
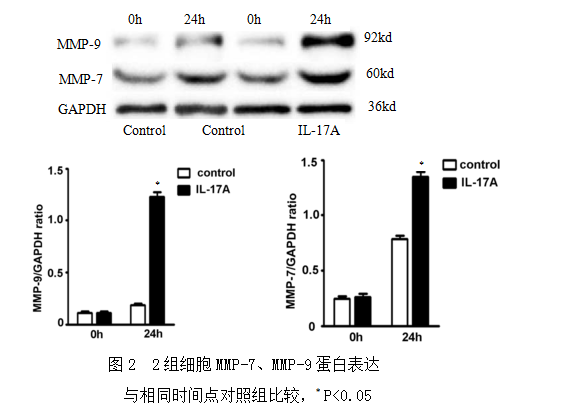
分别于IL-17A处理细胞0h和24h,收集对照组和处理组细胞,每孔加入150μl细胞裂解液,充分裂解后提取总蛋白,nanodrop2000超微量紫外分光光度计测定蛋白浓度,与样品处理液混合后煮沸10min,加样,每样品孔30ug,10% SDS-PAGE凝胶电泳,浓缩胶80V恒压电泳30min,分离胶140~180V,溴酚兰达凝胶底部停止电泳;半干转,恒压,20V、30min,将胶上的蛋白转移至PVDF膜上。5%脱脂奶粉封闭2h;MMP-7、MMP-9兔抗人单克隆抗体(1: 1000),4℃孵育过夜;TBST对膜进行清洗(15min,10min,10min),以洗掉非特异结合的一抗;HRP标记羊抗兔二抗(1:4000)室温孵育1h;TBST对膜进行清洗(5min×3);采用ECL发光法显影,化学发光底物A液与B液1:1混合,室温避光反应5min,Biorad化学发光成像系统扫描图像,目的蛋白/GAPDH条带的灰度比值进行半定量分析。
1.3.5 细胞划痕实验检测Ishikawa细胞迁移能力的变化
两组细胞行划痕实验:用10μL枪头比着直尺,垂直于培养板划痕;用PBS洗涤细胞,以去除划下的细胞,洗涤3次之后加入无血清DMEM培养基;置于37°、5% CO2的细胞培养箱中培养;计算各组细胞迁移距离。
1.4 统计学处理
结果以3次重复实验所得的均数±标准差(x±s)表示,采用GraphPad Prism5 统计软件进行单因素方差分析,Tukey法进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 外源性IL-17A对Ishikawa细胞迁移能力的影响
细胞于IL-17A处理2h行细胞划痕,分别于划痕后0h、6h、12h、24h拍照,检测各组细胞迁移能力的变化情况,可见IL-17A处理组细胞迁移能力增强,划痕6h、12h、24h迁移愈合距离均大于对照组,差异有统计学意义(表1,图1)。
2.2 2组细胞MMP-7及MMP-9蛋白表达
IL-17A处理细胞0h,2组细胞MMP-7及MMP-9蛋白表达均较低,差异无统计学意义;处理24h,IL-17A处理组MMP-7及MMP-9蛋白均高于对照组,差异均有统计学意义(图2)。
3 讨论
近年来,子宫内膜癌发生发展的免疫学机制在发病机制的探索中备受瞩目,寻找相关的免疫学因子显得尤为重要。T辅助淋巴细胞(T helper 17 cells,Th17)是近年来发现的可诱导组织发生强烈炎症反应的CD4+T细胞亚群,主要通过分泌IL-17募集中性粒细胞,引起炎症反应,在自身免疫性疾病、感染、肿瘤等疾病中发挥重要作用。IL-17作为Th17细胞分泌的标志性细胞因子,具有促炎、抗炎的双重作用,在细胞增殖分化、生物因子转录、表达等方面发挥重要作用。
MMP-9又称92kDⅥ型胶原酶或明胶酶B,与多种肿瘤的侵袭转移表型关系最为密切,其主要作用底物是基底膜及细胞外基质中的Ⅵ型胶原、明胶、弹力蛋白等,促进肿瘤细胞的侵袭和转移,在人肺癌、前列腺癌及黑色素瘤等的侵袭和转移中发挥重要作用。MMP-7又称作基质溶素,属于间质溶素类,主要作用于层粘连蛋白、纤维蛋白、蛋白多糖和核心蛋白,MMP-7还可以通过激活MMP-2和MMP-9来降解细胞外基质,进一步促进肿瘤细胞侵袭和转移,其作用在小鼠前列腺癌模型中得到了证实。本次研究发现,外源性IL-17A能够促进Ishikawa细胞的迁移,IL-17A处理组细胞高表达MMP-7及MMP-9蛋白,提示IL-17A可能通过上调MMP-7及MMP-9蛋白表达,促进Ishikawa细胞迁移。
参考文献
[1]Kolls JK,Linden A.Interleukin-17 family members and inflammation[J].Immunity,2004,21(4).
[2]Korn T,Bettell IE,Oukka M,et al.IL-17 and Th17 cells[J].Annu Rev Immunol,2009,27(1).
[3]Xu B,Guenther JF,Pociask DA,et al.Promotion of lung tumor growth by interleukin-17[J].Am J Physiol Lung Cell Mol Physiol,2014,307(6).
[4]Zhang Q,Liu S,Zhang Q,et al.Interleukin-17 promotes development of castration-resistant prostate cancer potentially through creating an immunotolerant and pro-angiogenic tumor microenvironment[J].Prostate,2014,74(8).
收稿日期:2018-01-04
作者简介:魏敏(1996-),女,江苏赣榆人,就读于华北理工大学临床医学院,研究方向:糖尿病的发病机制与药物治疗。魏静波为通讯作者。








