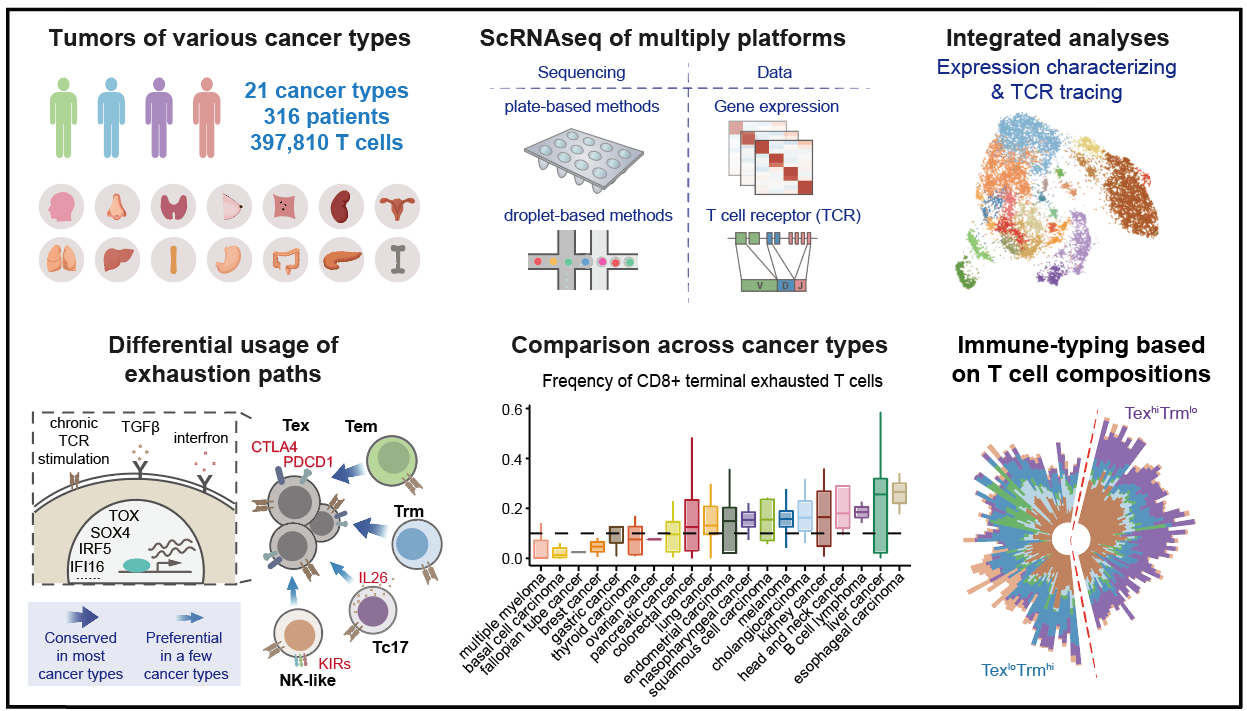
 T细胞单细胞图谱的研究框架和主要发现 (北京大学肿瘤医院供图)
T细胞单细胞图谱的研究框架和主要发现 (北京大学肿瘤医院供图)胃癌是严重危害中国人健康的恶性肿瘤,全球年新发病例逾百万,中国占44%,主要的临床问题是危害大、治疗难、预后差。相对其他肿瘤而言,胃癌治疗手段有限,药物选择相对较少,基于标准化治疗基础上的胃癌精准医疗的创新进展,有赖于对胃癌在内的癌细胞更加深层次的刻画,为寻找新型治疗靶点提供理论依据。
上述研究团队从临床问题出发,通过整合团队自己产出的单细胞转录组测序数据及已发表的公共数据,构建了以胃癌为代表的15个癌种内的髓系细胞图谱,并系统性地比较了各髓系细胞类群在不同癌种间组成、发育及功能上的异同。
在此基础上,研究团队进而构建了系统的单细胞水平泛癌症T细胞图谱,图谱涵盖了来自21种癌症类型的316名患者的397,810个高质量T细胞数据。共识别出17个CD8+ T细胞类群和24个CD4+ T细胞类群。不同组织来源的T细胞在组成上差异明显,表明肿瘤微环境明显地重塑了肿瘤浸润T细胞状态。
同时,研究揭示了CD8+ T细胞耗竭的两条常见路径,即分别通过效应记忆T细胞或组织驻留记忆T细胞达到终末耗竭状态。对于 CD4+ T细胞,研究发现肿瘤中的两种T滤泡辅助细胞,并进一步发现其与肿瘤突变负荷相关,提示了肿瘤细胞是如何塑造肿瘤微环境。最后根据肿瘤浸润T细胞的组成,肿瘤患者可以分为末期耗竭CD8+ T细胞占比高与组织驻留记忆CD8+ T细胞占比高的两个亚组群。基于T细胞的肿瘤免疫分型为理解肿瘤浸润T细胞的总体特性提供了理论基础,为开发新的癌症免疫疗法和患者筛选提供了理论依据。
联合研究团队进一步深入研究胃癌的肿瘤浸润T细胞组成及其转化路径,发现胃癌中的肿瘤浸润终末耗竭性T细胞主要通过ZNF683+CXCR6+组织驻留记忆T细胞即P2路经转化而来,而对于CD4+ T细胞群,TNFRSR9+ Treg则更多由SIPR1+Treg转化而来,研究为精准靶向胃癌肿瘤微环境中的特定肿瘤浸润T细胞提供了理论依据。研究发现胃癌肿瘤组织中的终末耗竭性T细胞、TNFRSR9+ Treg和TCF+耗竭性T细胞水平偏低,而ZNF683+CXCR6+组织驻留记忆T细胞水平则较高。
研究者进一步深入分析胃癌和其他肿瘤组织中的T细胞组成,发现胃癌肿瘤组织中存在较低比例的终末耗竭CD8+T细胞和较高比例的组织驻留记忆CD8+T细胞,暗示胃癌肿瘤微环境中具有较好的抗肿瘤T细胞组成,为进一步开发胃癌的精准靶向免疫治疗提供了理论依据。基于单细胞转录组数据的肿瘤T细胞组分分析将有望于肿瘤免疫治疗患者的精准筛选。
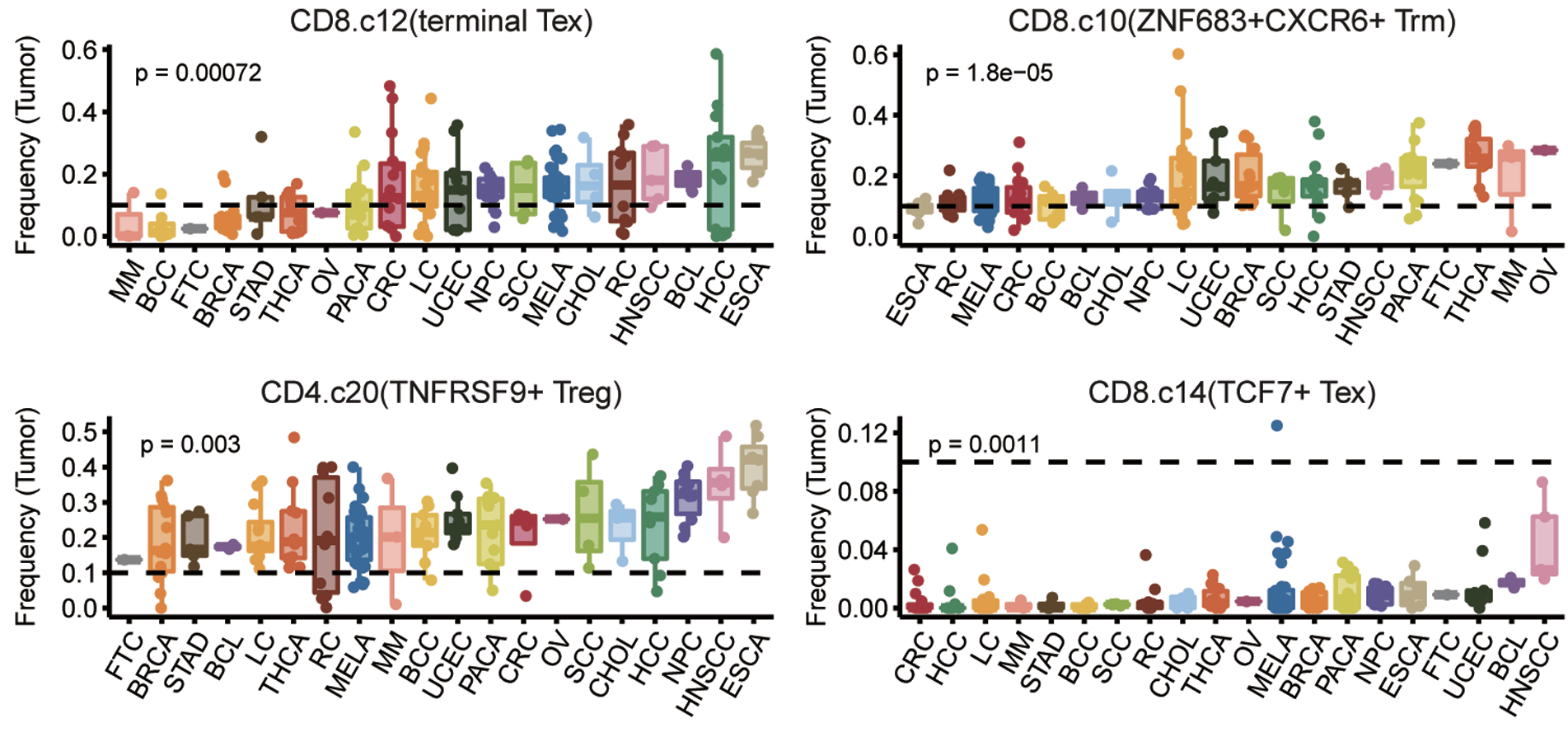
泛癌肿瘤浸润T细胞分布情况 (北京大学肿瘤医院供图)
研究团队完成包括胃癌在内的多种癌症类型的肿瘤微环境系统刻画,肿瘤微环境的特征性靶点为新的免疫靶向药物设计提供了理论依据与指导方向,将有望推动胃癌新型靶向诊疗水平新的提升,使更多胃癌患者获益。








