脱氧核糖核酸,也称去氧核糖核酸(deoxyribonucleic acid-DNA),属于一种生物大分子,储备着生物体赖以生存、繁衍的遗传信息,对生物发育、生命机能运作起到重要的引导作用。通常情况下,外界环境、生物体内部的温度、重金属、辐射等因素均会导致DNA损伤而产生致死性、丧失某些功能等不良后果。因此,维护DNA的完整性对细胞至关重要。羟基自由基(-OH)是一种活性氧,与机体所有细胞成分均可发生反应,一旦自由基过多,便会损伤机体,以-OH引起DNA的碱基、脱氧核糖产生化学变化,导致碱基脱落、脱氧核糖分解等不良后果。现阶段,针对光照激发光催化作用介导产生-OH引起DNA损伤机制的相关研究报道较少。基于此,本文以鲱鱼精DNA施以紫外光激发TIO2的光催化作用介导产生的-OH为基础,全面分析-OH、DNA两者的相互作用原理,以便了解-OH引起的DNA损伤的发生机制,分析如下。
1 资料与方法
1.1 仪器与试剂
1.1.1 仪器
德国Brucker公司提供的ESP300E波谱仪、北京市六一仪器厂提供的GE-100凝胶电泳仪、美国Waters公司提供的600E-SOLVENT高效液相色谱仪。
1.1.2 试剂
10.0mg/L8-羟基脱氧鸟苷(8-OHDG)溶液、10.0g/L N,N-二乙基对苯二胺(DPD)溶液、0.4mol/L5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)溶液、1.0g/L辣根过氧化物酶(POD)溶液、1.0.0mg/L鲱鱼精DNA水溶液。甲醇是色谱级。
1.2 方法
准备圆柱型硬质石英瓶,将10mg/L鲱鱼精DNA、1.0g/LTiO2置入瓶内,于暗处进行搅拌4小时,促使DNA吸附平衡在催化剂表面,计时,引人紫外光,间时留取样本予以分析,设Dark/TiO2、单纯UV为对照。在相同条件下调整不同底物pH、TiO2浓度,对影响光催化损伤DNA因素予以全面探究。
电泳分析:条件为电压101V、电流80mA、琼脂糖凝胶(1%正常熔点)、电泳时间0.5h,以凝腔成像系统利用中波302nm分析琼脂糖凝。
高效液相色谱分析:KromasilC18色谱柱、检测波长260nm、甲醇-0.05%醋酸钠溶液(流动相)、流速为0.5mL/min,自旋捕获剂为5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)溶液,直接在水相中捕捉自由基生成DMPO-OH加和物,利用电子自旋共振、分光光度法分别测定DNA损伤过程-OH、H20相对浓度变化。间时留取1mL样本,放在装有H2O2测定液的比色管内,定容,静置10min,进行离心处理,收集上清液,对其利用波长510nm予以检测。以HJ/L399-2007为依据,分析DNA损伤过程化学需氧量变化。
2 结果与讨论
2.1 DNA损伤的电泳分析
电泳图谱内DNA的3种形态(超螺旋、开环、线性)分布可有效反应DNA损伤程度,通过凝胶电泳检测DNA损伤程度,可得DNA片段随着光催化辐照时间延长而减少,致使DNA氧化损伤加重,特别是UV/TiO2,当辐照DNA3h,无SC DNA、L DNA、OCDNA形态,说明DNA完全损伤。
2.2 分析DNA色谱图
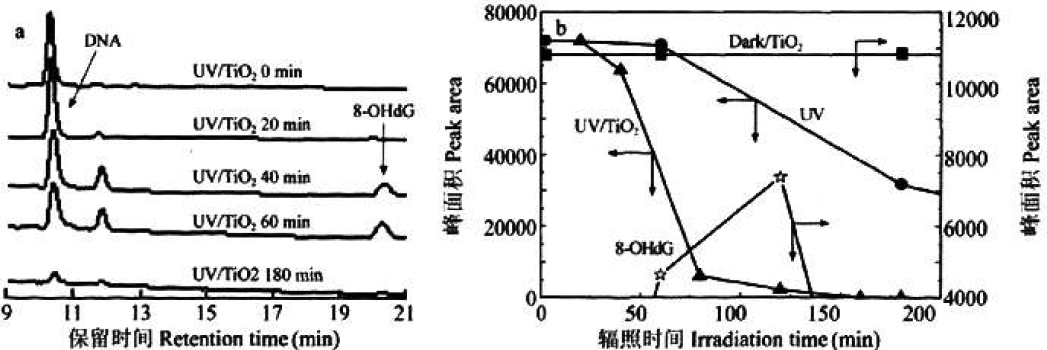
以高效液相色谱分析DNA色谱图1(a),随着辐照时间延长,10.4min的DNA峰面积呈缩小趋势。40min样品出现损伤产物峰,并且其面积随辐照时间延长呈先增后减变化。通过将8-羟基脱氧鸟苷作为内标物,证实DNA损伤中间产物是8-羟基脱氧鸟苷,因此,将DNA峰面积、8-羟基脱氧鸟苷峰面积进行辐照时长作图,见图1(b)。

(a)DNA损伤过程色谱图 (b)DNA损伤与其损伤产物动力学曲线
图1
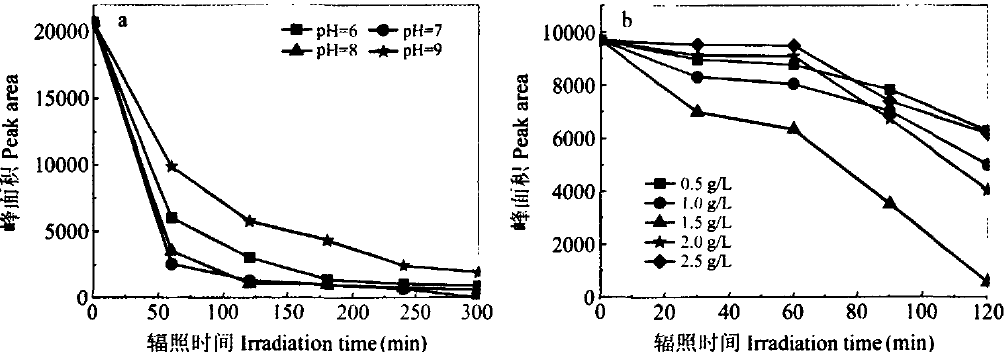
DNA氧化损伤严重程度依次是UV/TiO2、UV、Dark/Ti02,说明UV/TiO2的DNA氧化损伤度较重,当辐照1.5h,损伤可达99%,以8-OHdG浓度最高为损伤产物,其属于先生成后消失物质,是一种DNA氧化损伤的中间产物。当pH值接近中性,光催化引起DNA损伤程度最重,见图2(a);当TiO2浓度处于1.5g/L且辐照时长0.5h,DNA损伤程度为30%,光催化对DNA损伤程度最显著,见图2(b)。可知,DNA浓度、Ti02浓度分别处于10mg/L、1.5g/L且Ti02PH为7~8时,可显示出最高的光催化反应效率,进而DNA损伤严重。
(a)不同底物pH、TiO2浓度 (b)影响光催化产生的DNA氧化损伤
图2
2.3 DNA损伤期间的氧化物、H2O2相对浓度
经分析,UV、Dark/TiO2体系无H2O2产生且DNA未出现损伤,见图3(a)。当在此体系内引入紫外光、催化剂,产生大量H2O2且在反应8h浓度最高,随着辐照时间延长,其被紫外光分解,形成-OH。通过电子自旋共振对不同体系生成的-OH波谱信号予以检测,加以UV/TiO2对其辐照,可得强度为1:2:2:1的四重峰,说明-OH生成,见图3(b)。由此可知,UV/TiO2光催化作用介导会促进大量H202、-O的生成,体现出DNA氧化损伤过程存在-OH氧化。
(a)DNA氧化损伤期间的H202相对浓度变化 (b)UV/Ti02体系DMPO-OH加合物的ESR波谱信号
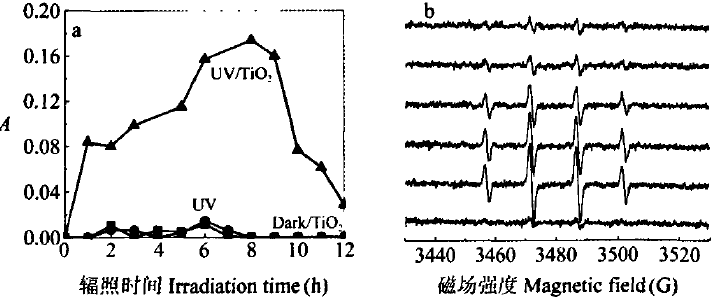
图3
2.4 -OH引起DNA损伤的机制
经过上述分析,可以发现紫外光通过激发TiO2光催化作用,可以产生-OH(氧化能力较强),其可以诱导DNA发生氧化损伤。鸟嘌呤是一种有机化合物,以嘌呤核苷酸形式存在,是-OH攻击DNA结构氧化损伤的首要位点,最终产生8-羟基脱氧鸟苷,即特异产物。可得,DNA损伤进程分析如下:鸟嘌呤发生自身氧化反应而转变成不稳定的鸟嘌呤基团,结合空气内氧、H+形成R-OOH,跟随体系重排反应,生成8-氧脱氧鸟嘌呤;紫外光激发TiO2介导产生-OH,其会促使8-氧脱氧鸟嘌呤发生氧化而生成8-羟基脱氧鸟苷;加上光催化反应,8-羟基脱氧鸟苷经-OH作用,逐渐氧化成小分子无机物,如CO2、H2O等。
参考文献
[1]由超.人源DNA聚合酶Polδ最小亚基p12及相关蛋白在DNA损伤和细胞凋亡过程的调控分析[D].镇江:江苏大学,2015.
[2]吴丽丹.DNA氧化损伤动力学机理研究:自由基反应及单电子氧化/脱质子反应[D].北京:中国科学院大学,2015.
[3]李洪亮,周漫,丁冶春,等.六月雪水提取物体外清除羟自由基活性的实验研究[J].赣南医学院学报,2016,36(1).
(作者系湘南幼儿师范高等专科学校高级讲师)








